Teori Kepolaran Senyawa Kovalen
Segala sesuatu di alam ini selalu membentuk suatu kestabilan. Begitu pula halnya dengan senyawa kimia. Senyawa kimia tersusun atas molekul atau atom. Atom-atom akan saling bergabung membentuk suatu ikatan kimia untuk mencapai kestabilan. Beberapa molekul terdiri atas atom-atom yang berbeda seperti garam (NaCl). Ada juga molekul yang terdiri atas atomatom yang sama seperti gas hidrogen (H2).Garam dapur merupakan contoh senyawa kimia yang banyak dimanfaatkan dalam kehidupan sehari-hari. Gambar di atas adalah Kristal garam dapur. Senyawa yang memiliki rumus kimia NaCl ini terdiri atas unsur natrium (Na) dan klorin (Cl). Unsur Na bersifat reaktif, reaksinya dengan air dapat menimbulkan ledakan. Adapun, unsur klorin bersifat toksik. Akan tetapi, ketika kedua unsur ini bergabung (berikatan) maka diperoleh senyawa baru yang dapat digunakan sebagai bumbu makanan. Pernahkah terpikirkan oleh Anda bagaimana atom-atom itu dapat berikatan?
Uji Coba Labs | Download File Labs
Lihat: Teori Kepolaran Senyawa Kovalen | Lihat: Lks Kepolaran Senyawa Kovalen
Anda dapat membuktikan bagaimana natrium dan klorin bergabung membentuk garam dapur dengan melakukan berbagai kegiatan dan tugas dalam bab ini. Selain itu, Anda juga dapat mempelajari fakta-fakta lain yang berkaitan dengan ikatan kimia, misalnya jenis ikatan dan proses pembentukan ikatan.
Lihat: Teori Kepolaran Senyawa Kovalen | Lihat: Lks Kepolaran Senyawa Kovalen
Anda dapat membuktikan bagaimana natrium dan klorin bergabung membentuk garam dapur dengan melakukan berbagai kegiatan dan tugas dalam bab ini. Selain itu, Anda juga dapat mempelajari fakta-fakta lain yang berkaitan dengan ikatan kimia, misalnya jenis ikatan dan proses pembentukan ikatan.
Kestabilan Unsur-Unsur Kimia di Alam
Pernahkah Anda menggunakan bedak padat? Bedak merupakan salah satu kosmetik yang sering digunakan dalam kegiatan sehari-hari. Bedak banyak digunakan karena kandungan kimia dalam bedak bermanfaat untuk kesehatan ataupun kecantikan. Tahukah Anda, bahan kimia apakah yang terkandung dalam bedak? Bedak adalah senyawa kimia yang memiliki rumus kimia Mg3Si4O10 (OH)2. Nama kimianya adalah magnesium silikat hidroksida. Berdasarkan rumus kimianya, bedak mengandung unsur Mg, Si, O, dan H. Unsur-unsur yang terdapat di dalam bedak tidak berbentuk atom bebas, melainkan bergabung dengan unsur-unsur lainnya membentuk senyawa.
Seperti halnya unsur-unsur kimia di dalam bedak, sebagian besar unsurunsur yang ada di alam ditemukan dalam bentuk senyawa. Jarang sekali yang ditemukan dalam bentuk unsur bebasnya. Mari, lakukan penyelidikan berikut agar Anda dapat membuktikan fakta tersebut.
1. Elektron Valensi Berhubungan dengan Sifat Unsur
Berdasarkan sifatnya, unsur-unsur kimia dapat dikelompokkan menjadi tiga kelompok, yaitu unsur logam, unsur nonlogam, dan unsur gas mulia. Unsur-unsur yang bersifat logam adalah unsur-unsur yang termasuk golongan IA, IIA, dan IIIA (kecuali boron), IVA (kecuali karbon dan silikon), sebagian VA (antimon dan bismut), IB, IIB, IIIB, IVB, VB, VIB, VIIB, dan VIIIB. Unsur-unsur yang bersifat nonlogam adalah unsur-unsur yang termasuk golongan IVA (karbon dan silikon), sebagian VA (kecuali antimony dan bismut), VIA, dan VIIA. Adapun unsur-unsur golongan VIIIA dinamakan gas mulia. Sifat logam, nonlogam, dan gas mulia berhubungan dengan electron valensi unsur. Perhatikanlah elektron valensi beberapa unsur dalam table berikut.
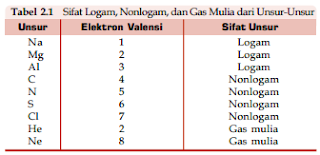
Berdasarkan tabel tersebut, atom unsur yang memiliki elektron valensi 1, 2, dan 3 tergolong ke dalam unsur logam. Atom dengan elektron valensi 4, 5, 6 dan 7 termasuk unsur nonlogam. Adapun unsur gas mulia memiliki elektron valensi 2 dan 8.
2. Susunan Elektron Valensi Unsur Digambarkan dengan Struktur Lewis
Apakah perbedaan antara unsur logam, nonlogam, dan gas mulia? Jawabannya akan lebih mudah diketahui dengan menggambarkan susunan elektron valensi unsur.

Perhatikan gambar susunan elektron unsur He dan Ar. Pada kedua unsur tersebut, setiap kulit elektron terisi penuh. Lain halnya dengan unsur Na dan Cl, kulit terakhirnya tidak terisi penuh. Kulit ketiga atom Na hanya berisi 1 elektron, sedangkan kulit ketiga atom Cl berisi 7 elektron. Jumlah elektron maksimum kulit ketiga adalah 8. Jumlah elektron di kulit terluar disebut elektron valensi. Elektron valensi unsur dapat juga digambarkan menggunakan struktur Lewis. Struktur Lewis adalah suatu kaidah penggambaran elektron valensi unsur yang dikemukakan oleh ahli kimia Amerika, G.N. Lewis. Dalam struktur Lewis, yang digambarkan hanya elektron valensinya saja. Berikut struktur Lewis untuk unsur Na, Cl, Ne, dan He.


